Article
Aug 19, 2025
ChatGPT 5 al 30% de potencia de razonamiento versus Patólogo experto.
Experimento In Silico, poniendo a prueba Chat GPT con la base de datos publica de TG del Doctor Andric Guerrero.
Evaluación integral de chat GPT 5 modelo de razonamiento al 30% de potencia versus un asistente de patología
Autor: Doctor Andric Guerrero E.
Ámbito: Patología quirúrgica – cortes teñidos con H-E suministrados como imágenes estáticas (no WSI)
Objetivo: Documentar con rigor cómo el LLM GPT V5 al 19 de agosto del 2025 trabajo cada caso, qué diagnostico, cómo me desplazo por las láminas y en qué difirió respecto de los diagnósticos de referencia. El modelo asumio: " Extraigo lecciones, propongo checklists de verificación y cierro con una valoración honesta del desempeño y de los límites actuales del modelo"
1) Metodología de lectura
1.1. Flujo de trabajo
Bajo aumento: identificación de arquitectura global (epitelio, relación con el estroma, patrón de invasión/expansión, ulceración).
Barrido sistemático: cuadriculado mental (y, cuando fue posible, marcado en las imágenes) para recorrer Q1→Q4 sin saltos.
Selección de ROIs: zonas con mayor densidad diagnóstica (transición epitelio-estroma, áreas atípicas, glándulas sospechosas, nidos basaloides, etc.).
Aumento intermedio y alto: valoración citológica (pleomorfismo, nucléolos, mitosis, polaridad) y del patrón (p. ej., glomeruloide en próstata, cribiforme, ductos destruidos, LEL, retracción estromal).
Diferencial estructurado: descartar mimickers habituales con una lista corta de banderas rojas.
Si persiste duda: proponer IHQ mínima guiada por la morfología (p63/CK5/6 en escamosas; p63/HMWCK/AMACR en próstata; p16/Ki-67 en NIC; AE1/AE3 y mucinas en GI; CK7/CK20/GATA3/TTF1 según metástasis).
1.2. Herramientas visuales
Desplazamiento por cuadrantes + ROIs anotados.
Mapas de bordes (saliencia) sencillos para resaltar interfaces tumor-estroma, luces glandulares y contornos papilares.
En algunos casos, zooms seriados para seguir continuidad entre superficie y profundidad.
2) Resultados por caso: qué vi, qué informé y en qué fallé
Caso A — Biopsia cervical
Lo pedido: diferenciar NIC de bajo vs alto grado.
Mi lectura: LSIL/NIC 1 con patrón condilomatoso. Señalé maduración conservada, atipia leve basal y coilocitosis sutil.
Diagnóstico de referencia: NIC 3 (HSIL).
Análisis del desajuste:
Probable subestimación de la pérdida de maduración y de la extensión vertical de la atipia por campo y calidad de imagen.
Mitosis suprabasales y hipercromasia difusa pudieron estar presentes pero infrarrepresentadas en los cortes mostrados.
Heurística que me sesgó: presencia de rasgos condilomatosos → anclaje en LSIL.
Checklist correctivo para NIC/HSIL
Verificar polaridad en los tres tercios, mitosis por encima del tercio medio, núcleos en “crowding” y pérdida de estratificación.
Si hay duda: p16 (bloque difuso) y Ki-67 ascendente.
Puntaje otorgado: 11/20.
Caso B — Ganglio linfático: ¿reactivo o metástasis?
Mi lectura: Tumor de Warthin (epitelio oncocítico con estroma linfoide reactivo, sin desmoplasia franca).
Diagnóstico de referencia: Metástasis ganglionar por adenocarcinoma infiltrante.
Qué me hizo errar:
Arquitectura con nidos/glandes sobre fondo linfoide imitó un Warthin.
Infravaloré señales de adenocarcinoma metastásico: glándulas irregulares de una sola capa, atipia citológica más marcada, patrón infiltrativo y focos de desmoplasia periférica.
Cómo lo evitaré:
Buscar doble capa (luminal oncocítica + basal/mioepitelial) → si ausente, sospechar metástasis.
Aplicar p63/CK5/6/SMA (capa basal) y AE1/AE3/CK7; añadir panel dirigido a primario probable (TTF-1/Napsina A, GATA3, CDX2/CK20, PAX8).
Atención al borde: la desmoplasia en un ganglio es pista mayor de infiltración tumoral.
Puntaje otorgado: 8/20.
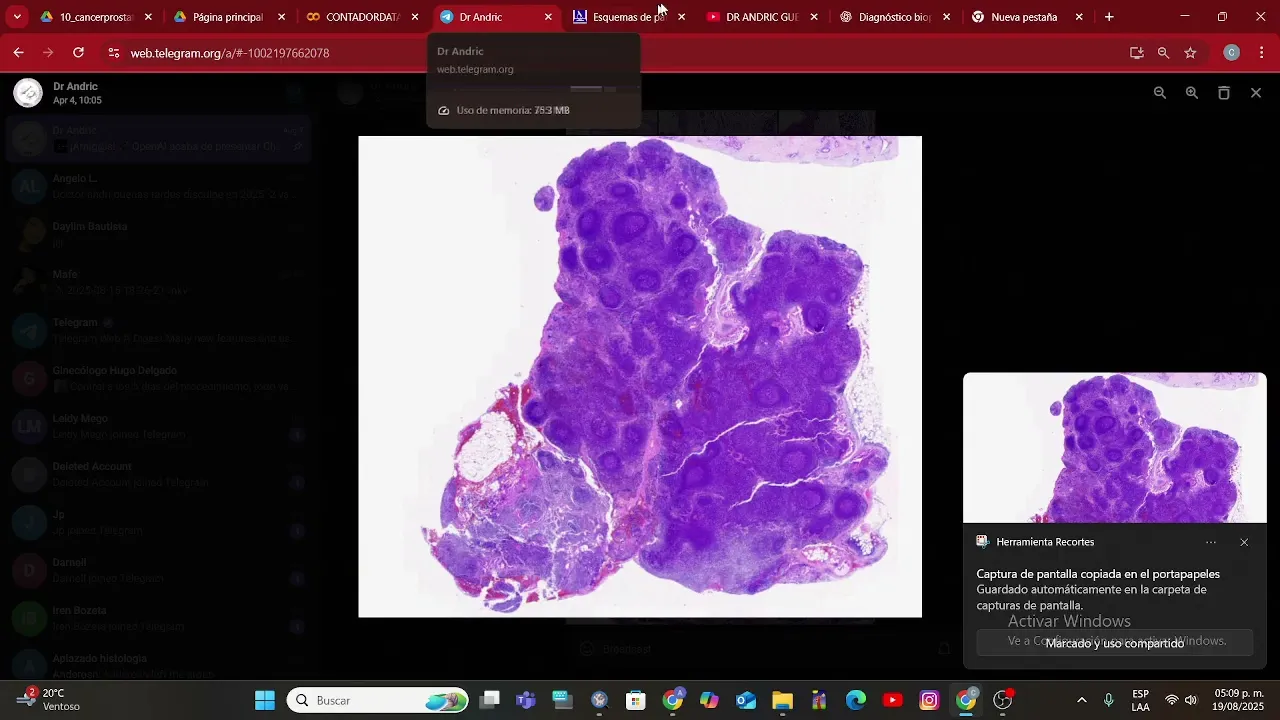
Caso C — Lesión cutánea de mejilla
Mi lectura: Carcinoma basocelular (nodular con componente infiltrativo/micronodular).
Diagnóstico de referencia: Carcinoma basocelular.
Claves morfológicas acertadas: palisadeo periférico, retracción estroma-tumor, nidos basaloides con estroma mixo-fibroso, brotes desde la epidermis.
Comentario de manejo: por localización facial + componente infiltrativo, recomendé control de márgenes (p. ej., Mohs).
Puntaje otorgado: 20/20.
Caso D — Biopsia core de próstata
Mi lectura: Adenocarcinoma acinar 3+4=7 (ISUP 2) con patrón 4 glomeruloide/microcribriform (~20–30%); compromiso >50–60% del cilindro.
Diagnóstico de referencia: Carcinoma de próstata (concordante).
Fortalezas: reconocí acinos pequeños infiltrativos, ausencia de capa basal, nucléolos prominentes y el patrón 4 glomeruloide.
Mejoras posibles: objetivar con precisión longitud tumoral (mm), porcentaje de patrón 4 y perineural con WSI.
Puntaje otorgado: 18/20.
Caso E — Biopsia gástrica 1 (lesión ulcerada)
Mi lectura: Linfoma MALT (infiltrado monótono, LEL, gastritis crónica activa).
Diagnóstico de referencia: Adenocarcinoma gástrico.
Dónde me desvié:
Anclaje en “LEL”: interpreté la colonización glandular por linfocitos como neoplasia B; sin WSI, algunos túbulos mal formados y desmoplasia pueden pasar como inflamación.
Insuficiente evaluación de citología epitelial: atipia glandular sutil y infiltración desordenada no quedaron demostradas inequívocamente en las imágenes proporcionadas.
Contramedidas:
En úlcera con infiltrado dudoso, AE1/AE3 (highlight epitelio), mucinas (PAS-D, mucicarmina) y p53 si sugiere vía mutada.
Mantener como pitfall: H. pylori + hiperplasia folicular vs adenocarcinoma temprano.
Puntaje otorgado: 10/20.
Caso F — Biopsia gástrica 2 (mayor aumento)
Mi lectura: Xantoma/gastritis xantomatosa (histiocitos espumosos CD68-like).
Diagnóstico de referencia: Adenocarcinoma gástrico.
Por qué fallé:
Células con vacuolas y núcleo no tan periférico me orientaron a histiocitos; pasé por alto discohesión y patrón de infiltración compatibles con carcinoma pobremente cohesivo / tipo difuso.
Este es un pitfall clásico: signet-ring vs histiocito espumoso.
Regla de oro que debí aplicar:
Si hay duda entre histiocito vs tumor epitelial, hacer queratinas (AE1/AE3, CK7) y CD68/CD163 en espejo.
En anillo de sello verdadero: vacuola de mucina dominante desplaza el núcleo a la periferia (en media luna); en histiocito, el núcleo suele mantenerse central y el citoplasma es granular.
Puntaje otorgado: 5/20.

Promedio global: 12/20 (60%).
Fortalezas: dermatopatología básica (CBC), patología prostática (patrón 3/4), reconocimiento arquitectural general.
Debilidades:
Gradación NIC alta vs baja cuando la imagen no permite evaluar el espesor completo y mitosis suprabasales.
Metástasis a ganglio con estroma reactivo linfoide (confusión con lesiones salivares benignas).
Adenocarcinoma gástrico (especialmente difuso/indiferenciado) vs procesos inflamatorios (xantoma) o linfoproliferativos (MALT).
4) Taxonomía de errores y sesgos cognitivos
Anclaje por rasgos llamativos
Coilocitos → LSIL; linfostroma + glándulas → Warthin; vacuolas → xantoma.
Acción: forzar un chequeo de “banderas rojas” antes de cerrar.
Satisficing por campo limitado
Con pocas áreas a gran aumento, acepté explicaciones suficientes sin confirmar en bordes (p. ej., desmoplasia, invasión complementaria).
Acción: exigir WSI o múltiples campos y, de no tenerlos, bajar el nivel de certeza explícitamente.
Confusión célula-tipo
Anillo de sello vs histiocito; adenoca metastásico vs epitelio de glándula salivar.
Acción: queratinas vs CD68 como panel de choque.
Infravaloración de patrón
Falta de pérdida de maduración global (NIC 3) y patrón infiltrativo (metástasis, adenoca GI).
Acción: listas de verificación por órgano.
5) Checklists prácticos (para pegar junto al microscopio)
5.1. NIC (cérvix)
¿Se pierde la polaridad en ≥2/3 del espesor?
¿Mitosis suprabasales / atípicas?
p16 en bloque? Ki-67 asciende?
Coilocitos no excluyen HSIL.
5.2. Ganglio con glándulas
¿Doble capa (basal/mioepitelial) preservada?
Desmoplasia en borde? Fusión glandular irregular?
AE1/AE3/CK7 y p63/CK5/6/SMA en espejo; añadir marcadores según primario.
5.3. Estómago: ulceración con células vacuoladas
¿Núcleo periférico aplanado (anillo de sello) o central redondo (histiocito)?
¿Discohesión y permeación en lámina propia?
Queratinas (AE1/AE3/CK7) vs CD68/CD163; PAS-D/mucicarmina.
5.4. Próstata
Patrón infiltrativo de acinos pequeños, ausencia de capa basal (p63/HMWCK-), AMACR+.
Patrón 4: glomeruloide, cribiforme poco complejo, fusiones.
6) Propuestas de mejora del flujo de trabajo
Exigir WSI o set de campos que incluya borde tumoral y zonas ambiguas.
Paneles “de choque” predefinidos por duda diagnóstica frecuente (queratinas vs histiocitos; basal/mioepitelial vs adenoca, p16/Ki-67).
Política de incertidumbre explícita: si las imágenes no permiten ver criterios cardinales, no sobrediagnosticar; emitir informe condicional y recomendar IHQ.
Entrenamiento con “pitfalls”: colecciones curadas de anillos de sello vs xantomas, metástasis en ganglio vs Warthin, HSIL con cambios productivos de VPH.
Checklist forzado antes de cerrar (5-10 ítems, órgano-específicos).
7) Conclusión
Los experimentos muestran una evolución positiva respecto a hace algunos meses: hay consistencias en patrones clásicos (carcinoma basocelular y carcinoma prostático con patrón glomeruloide) y una metodología de lectura más ordenada (barrido por cuadrantes, ROIs, saliencia). Sin embargo, el modelo de razonamiento del Plan Plus aún no es comparable a un patólogo experto, especialmente en situaciones límite (HSIL vs LSIL en cérvix con imágenes acotadas; metástasis con estroma linfoide; adenocarcinoma gástrico –sobre todo difuso– frente a mímicos inflamatorios).
Nivel actual: razonable para un residente de 1.º–2.º año de patología, no al nivel de un doctorado/fellow ni de un especialista sénior. Para acortar esa brecha se requiere acceso a WSI, aplicación consistente de paneles IHQ de descarte, y disciplina con checklists órgano-específicos antes de emitir un diagnóstico definitivo.
